
Дарбэстим®
Фармакологические группы:
Международный классификатор болезней (МКБ-10):
Состав и форма выпуска
Раствор для инъекций прозрачный, бесцветный.
| 1 мл | 1 шприц (0.6 мл) | |
| дарбэпоэтин альфа (рекомбинантный) | 500 мкг | 300 мкг |
Вспомогательные вещества: натрия дигидрофосфата моногидрат - 2.118 мг, натрия гидрофосфат - 0.661 мг, натрия хлорид - 8.812 мг, полисорбат 80 - 0.05 мг, вода д/и - до 1 мл.
0.6 мл - шприцы стеклянные (1) - упаковки ячейковые контурные (1) в комплекте со спиртовыми салфетками (1 шт.) - пачки картонные.
0.6 мл - шприцы стеклянные с системой защиты иглы (1) - упаковки ячейковые контурные (1) в комплекте со спиртовыми салфетками (1 шт.) - пачки картонные
Описание лекарственной формы
Раствор для инъекций.
Фармакологическое действие
Стимулятор гемопоэза, антианемический препарат. Дарбэпоэтин альфа производится с использованием генной технологии в клетках яичников китайского хомяка (СНО-К1). Стимулирует эритропоэз по тому же механизму, что и эндогенный эритропоэтин. Дарбэпоэтин альфа содержит пять N-связанных углеводных цепей, в то время как эндогенный гормон и рекомбинантные человеческие эритропоэтины (рчЭпо) имеют всего три цепи. Дополнительные остатки сахаров, с молекулярной точки зрения, не отличаются от таковых, представленных в эндогенном гормоне. Вследствие повышенного содержания углеводов дарбэпоэтин альфа обладает более длительным T1/2, по сравнению с рчЭпо, а, следовательно, и большей активностью in vivo. Несмотря на указанные изменения молекулярной структуры дарбэпоэтин альфа сохраняет очень узкую специфичность к эритропоэтиновому рецептору.
Эритропоэтин - фактор роста, который в основном стимулирует образование эритроцитов. Рецепторы к эритропоэтину могут экспрессироваться на поверхности различных опухолевых клеток.
Показания
Лечение симптоматической анемии у взрослых и детей c хронической почечной недостаточностью.
Лечение симптоматической анемии у взрослых пациентов с немиелоидными злокачественными новообразованиями, получающих химиотерапию.
Режим дозирования
В зависимости от показаний, возраста, состояния пациента начальная доза составляет для п/к или в/в введения составляет 0.45 мкг/кг, или для п/к введения 0.75 мкг/кг, 2.25-6.75 мкг/кг. Поддерживающая доза, частота введения, длительность лечения зависят от эффективности и клинической ситуации. Лечение проводят под контролем уровня гемоглобина.
Противопоказания к применению
Плохо контролируемая артериальная гипертензия; повышенная чувствительность к дарбэпоэтину альфа, рекомбинантному человеческому эритропоэтину.
Применение при беременности и кормлении грудью
Адекватных и строго контролируемых клинических исследований по безопасности применения при беременности не проводилось. С осторожностью и после тщательной оценки ожидаемой пользы терапии для матери и потенциального риска для плода возможно применение дарбэпоэтина альфа при беременности женщинам.
При необходимости применения дарбэпоэтина альфа в период лактации грудное вскармливание следует прекратить.
Побочные действия
Аллергические реакции: анафилактические реакции, ангионевротический отек, аллергический бронхоспазм, сыпь и крапивница.
Со стороны сердечно-сосудистой системы: очень часто - повышение АД.
Дерматологические реакции: часто - сыпь, эритема.
Со стороны системы кроветворения: тромбоэмболия.
Местные реакции: боль в месте инъекции.
Прочие: парциальная красноклеточная аплазия (главным образом у пациентов с хронической почечной недостаточностью, получавших препарат п/к).
Взаимодействие
Известно, что возможно взаимодействие дарбэпоэтина альфа с препаратами, характеризующимися высокой степенью сродства к эритроцитам, такими как циклоспорин, такролимус. При одновременном применении дарбэпоэтина альфа с любыми подобными лекарственными средствами следует контролировать уровень их содержания в сыворотке крови с модификацией дозы в случае повышения концентрации гемоглобина.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Производитель
ЗАО «БИОКАД», Россия, 143422, Московская обл., Красногорский р-н, с. Петрово-Дальнее.
Условия отпуска из аптек
Отпускают по рецепту.
Фармакодинамика
Дарбэпоэтин альфа стимулирует эритропоэз по тому же механизму, что и эндогенный эритропоэтин. Дарбэпоэтин альфа содержит пять N-связанных углеводных цепей, в то время как эндогенный гормон и рекомбинантные человеческие эритропоэтины (рчЭпо) имеют всего три цепи. Дополнительные остатки сахаров, с молекулярной точки зрения, не отличаются от таковых, представленных в эндогенном гормоне. Вследствие повышенного содержания углеводов дарбэпоэтин альфа обладает более длительным периодом полувыведения в сравнении с рчЭпо, а, следовательно, и большей активностью in vivo. Несмотря на указанные изменения молекулярной структуры дарбэпоэтин альфа сохраняет очень узкую специфичность к эритропоэтиновому рецептору.
Эритропоэтин – фактор роста, который в основном стимулирует образование эритроцитов. Рецепторы к эритропоэтину могут экспрессироваться на поверхности различных опухолевых клеток.
Больные с хронической почечной недостаточностью
В 2 клинических исследованиях было выявлено, что у пациентов с ХПН риск летального исхода и серьезных сердечно-сосудистых нежелательных явлений выше при применении стимуляторов эритропоэза до более высоких целевых уровней гемоглобина при сравнении с более низкими (135 г/л (8,4 ммоль/л) против 113 г/л (7,1 ммоль/л); 140 г/л (8,7 ммоль/л) против 100 г/л (6,2 ммоль/л).
В рандомизированном, двойном слепом коррекционном исследовании (n = 358) сравнения режимов дозирования один раз каждые две недели и один раз в месяц у пациентов с хронической почечной недостаточностью, не находящихся на диализе, применение дарбэпоэтина альфа для коррекции анемии один раз в месяц было не хуже, чем один раз каждые две недели. Среднее время (1-й Квартиль, 3-й Квартиль) достижения коррекции уровня гемоглобина (≥100 г/л и ≥10 г/л по сравнению с исходным уровнем) составило 5 недель для обоих режимов дозирования (3,7 недель для режима дозирования один раз каждые две недели и 3,9 недель для режима дозирования один раз в месяц). В период оценки (недели 29-33), среднее значение (95% ДИ) эквивалентной дозы составило 0,20 (0,17; 0,24) мкг/кг при режиме дозирования один раз каждые две недели и 0,27 (0,23; 0,32) мкг/кг при режиме дозирования один раз в месяц.
В рандомизированном, двойном слепом, плацебо-контролируемом исследовании (TREAT) 4038 пациентов с хронической почечной недостаточностью, с диабетом 2 типа и уровнем гемоглобина ≤110 г/л, не находящихся на диализе, получали дарбэпоэтин альфа с целью достижения уровня гемоглобина 130 г/л или плацебо (с назначением дарбэпоэтина альфа при снижении уровня гемоглобина ниже 90 г/л). Исследование не достигло основной цели, заключающейся в снижении риска смертности по любым причинам или по сердечно-сосудистой заболеваемости (дарбэпоэтин альфа vs плацебо; соотношение рисков 1,05; 95% ДИ (0,94; 1.17), равно как и цели заключающейся в снижении смертности по любым причинам и прогрессирования до терминальной стадии почечной недостаточности (ТСПН) (дарбэпоэтин альфа vs плацебо; соотношение рисков 1,06; 95% ДИ (0,95; 1,19). Анализ индивидуальных компонентов композитных конечных точек показал следующее соотношение рисков (95% ДИ): летальный исход 1,05 (0,92; 1,21), хроническая сердечная недостаточность (ХСН) 0,89 (0,74; 1,08), инфаркт миокарда (ИМ) 0,96 (0,75; 1,23), инсульт 1,92 (1,38; 2,68), госпитализация в связи с ишемией миокарда 0,84 (0,55; 1,27), ТСПН 1,02 (0,87; 1.18).
Онкологические больные, получающие химиотерапию
Выживаемость и прогрессирование опухоли были изучены в общей сложности у 2833 пациентов в рамках пяти крупных контролируемых исследований. Из них четыре были двойными слепыми и плацебо-контролируемыми, а одно – открытым. В двух исследованиях включались больные, которым уже было проведено химиотерапевтическое лечение. В двух исследованиях целевой уровень гемоглобина устанавливался равным и выше 130 г/л, а в трех других – в интервале от 120 до 140 г/л. В открытом исследовании не получено различий в показателях общей выживаемости между группой, получавшей лечение рчЭПО, и контрольной. В четырех плацебо-контролируемых исследованиях показатели риска были в пользу контроля и находились в пределах от 1,25 до 2,47. В этих четырех исследованиях был выявлен необъяснимый статистически достоверный прирост смертности по сравнению с контролем у больных с типичными видами рака и анемией, лечение которой проводилось рчЭПО. Сравнение частоты тромбозов и других осложнений в группах, получавших лечение рчЭПО, и контрольной, не дает удовлетворительного объяснения причин этого прироста.
Также был проведен систематический анализ 57 исследований, включавших суммарно более 9000 онкологических пациентов. При метаанализе общей выживаемости показатель риска равнялся 1,08 в пользу контроля (ДИ 95%: 0,99-1,18; 8167 пациентов в 42 исследованиях).
У пациентов, получавших лечение рчЭПО, отмечалось повышение относительного риска развития тромбоэмболических событий (ОР=1,67; ДИ 95%: 1,35-2,06; 6769 пациентов в 35 исследованиях). Таким образом, существует достаточный объем данных, свидетельствующих о возможности возникновения значительного вреда при лечении онкологических больных рчЭПО. Неясно, до какой степени это применимо к случаям назначения рекомбинантных человеческих эритропоэтинов для достижения целевого уровня гемоглобина менее 130 г/л у пациентов с онкологическими заболеваниями, которые получают химиотерапию, поскольку в проанализированных данных имелось незначительное число пациентов с такими характеристиками.
Также был проведен анализ данных более чем у 13900 пациентов со злокачественными заболеваниями (химиотерапия, лучевая терапия, химиотерапия и лучевая терапия или отсутствие терапии), включенных в 53 контролируемых клинических исследования нескольких эпоэтинов. Метаанализ данных по общей выживаемости выявил соотношение рисков 1,06 в пользу контрольной группы (95% ДИ: 1,00; 1,12; 53 исследования и 13933 пациента), и для пациентов со злокачественными заболеваниями, получающими химиотерапию, соотношение рисков общей выживаемости составило 1,04 (95% ДИ: 0,97; 1,11; 38 исследований и 10441 пациента). Метаанализ также указывает на значительное повышение относительного риска тромбоэмболических событий у пациентов со злокачественными образованиями, получающих рекомбинантный человеческий эритропоэтин (см. раздел «Особые указания»).
Доклинические данные по безопасности
Во всех исследованиях на крысах и собаках при применении дарбэпоэтина альфа значимо возрастала концентрация гемоглобина, гематокрита, эритроцитов и ретикулоцитов, что соответствует ожидаемому фармакологическому эффекту. Нежелательные явления при введении очень высоких доз препарата рассматривались как следствие усиленного фармакологического действия (снижения тканевого кровотока вследствие увеличения вязкости крови). Сюда же были отнесены миелофиброзы и гипертрофия селезенки, а также расширение комплекса QRS на ЭКГ у собак, без нарушения сердечного ритма и влияния на интервал QT.
Дарбэпоэтин альфа не обладал каким-либо генотоксическим потенциалом и не оказывал влияния на пролиферацию клеток негематологического ряда ни in vitro, ни in vivo. В исследованиях по хронической токсичности не наблюдалось туморогенного или неожиданного митогенного ответа ни в одном изученном типе тканей. В продолжительных исследованиях на животных оценка канцерогенного потенциала дарбэпоэтина альфа не выполнялась.
В испытаниях, проводившихся на крысах и кроликах, не наблюдалось клинически значимого влияния на беременность, эмбриональное/фетальное развитие, роды или постнатальное развитие. Уровень проникновения препарата через плаценту был минимальным. Изменений фертильности не отмечалось.
Фармакокинетика
В связи с повышенным содержанием углеводов концентрация циркулирующего в крови дарбэпоэтина альфа превышает минимальную концентрацию необходимую для стимуляции эритропоэза в течение более продолжительного времени в сравнении с эквивалентными дозами рчЭпо, что позволяет снизить частоту введения дарбэпоэтина альфа с сохранением эквивалентного уровня биологического ответа.
Больные с хронической почечной недостаточностью
Фармакокинетика дарбэпоэтина альфа была изучена у больных с хронической почечной недостаточностью при внутривенном и подкожном введении препарата. Его период полувыведения составлял 21 час (стандартное отклонение (СО) 7,5) при внутривенном введении. Клиренс дарбэпоэтина альфа составил 1,9 мл/час/кг (СО 0,56), а объем распределения (Орс) был приблизительно эквивалентен объему плазмы (50 мл/кг). При подкожном введении препарата его биодоступность соответствовала 37%. При ежемесячном подкожном введении дарбэпоэтина альфа в дозе от 0,6 до 2,1 мкг/кг его период полувыведения составлял 73 часа (СО 24). Более продолжительный период полувыведения дарбэпоэтина альфа при подкожном введении, по сравнению с внутривенным, обусловлен кинетикой абсорбции. В ходе клинических исследований минимальное накопление препарата наблюдалось при любом способе введения. В доклинических исследованиях было продемонстрировано, что почечный клиренс дарбэпоэтина минимален (до 2% общего клиренса) и не оказывает влияния на период полувыведения препарата из сыворотки.
Фармакокинетика дарбэпоэтина альфа изучалась у детей (3-16 лет) с ХПН, находящихся или не находящихся на диализе, при этом забор образцов проводился от момента однократного подкожного или внутривенного введения препарата до одной недели (168 часов) после введения. Периоды забора образцов были такой же продолжительности, как и у взрослых с ХПН, и сравнение показало, что фармакокинетика дарбэпоэтина альфа у взрослых и детей с ХПН похожа. После внутривенного введения препарата отмечалось приблизительно 25% различие между взрослыми и детьми в отношении площади под фармакокинетической кривой «концентрация-время» от нулевой отметки времени до бесконечности (AUC[0-∞]); тем не менее, указанное различие для детей составило менее двухкратного диапазона AUC[0-∞]. После подкожного введения препарата величина AUC[0-∞] у взрослых и детей была аналогичной. Как после внутривенного, так и после подкожного введения препарата, период полувыведения препарата у детей и взрослых с ХПН был сходен.
Онкологические больные, получающие химиотерапию
После подкожного введения препарата в дозе 2,25 мкг/кг взрослым онкологическим больным средние максимальные концентрации дарбэпоэтина альфа, составляющие 10,6 нг/мл (СО 5,9), устанавливались в среднем в течение 91 часа (СО 19,7). Эти параметры соответствовали линейной фармакокинетике дозы в широком диапазоне значений (от 0,5 до 8 мкг/кг при еженедельном введении от 3 до 9 мкг/кг при введении раз в две недели).
Фармакокинетические параметры не изменялись при многократном дозировании в течение 12 недель (еженедельное введение или введение раз в две недели). Отмечалось ожидаемое умеренное повышение (<2-кратное) сывороточной концентрации препарата при достижении равновесного состояния, но не было выявлено признаков его накопления при повторном назначении. Исследования фармакокинетики были выполнены с привлечением пациентов с индуцированной во время химиотерапии анемией, которые в комбинации с химиотерапией подкожно получали инъекции дарбэпоэтина альфа в дозе 6,75 мкг/кг раз в три недели. В данном исследовании среднее значение (СО) периода полувыведения составляло 74 (СО 27) часа.
Передозировка
Максимальное количество дарбэпоэтина альфа, безопасное для введения в виде однократной или многократной дозы, не определялось. В случае недостаточного контроля уровня гемоглобина и титрования дозы, терапия дарбэпоэтином альфа может привести к полицитемии. После передозировки дарбэпоэтином альфа наблюдались случаи тяжелой гипертензии.
В случае выявления полицитемии введение дарбэпоэтина альфа следует временно прекратить. При наличии клинических показаний может быть выполнена флеботомия.
Особые указания
С осторожностью следует применять у пациентов с заболеваниями печени, серповидно-клеточной анемией.
Необходим мониторинг АД у всех пациентов, особенно в начале терапии дарбэпоэтином альфа.
С целью подтверждения эффективности эритропоэза всем больным следует определять содержание железа до и во время лечения с целью назначения, в случае необходимости, дополнительной терапии препаратами железа.
При отсутствии ответа на применение дарбэпоэтина альфа следует выявить причину. Эффективность стимулирующих эритропоэз веществ снижается при недостатке в организме железа, фолиевой кислоты или витамина В12, вследствие этого уровень их содержания необходимо корректировать. Эритропоэтический ответ также может быть ослаблен при наличии сопутствующих инфекционных заболеваний, симптомов воспаления или случаев травмы, скрытой кровопотери, гемолиза, тяжелой алюминиевой интоксикации, сопутствующих гематологических заболеваний или фиброза костного мозга. Численность ретикулоцитов следует рассматривать как один из параметров оценки. Если типичные причины отсутствия ответа исключены, а у больного выявляется ретикулоцитопения, следует провести исследование костного мозга. Если картина костного мозга соответствует картине парциальной красноклеточной аплазии (ПККА), рекомендуется выполнить исследование на присутствие антител к эритропоэтину.
ПККА, вызванная нейтрализующим действием антиэритропоэтиновых антител, была описана в связи с применением рекомбинантных эритропоэтинов, включая и дарбэпоэтин альфа. Чаще всего такие сообщения касались пациентов с хронической почечной недостаточностью, получавших препарат п/к. Было показано, что эти антитела перекрестно реагируют со всеми эритропоэтинами. В случае постановки диагноза ПККА, лечение дарбэпоэтином необходимо прекратить без последующего перевода пациента на терапевтический режим, включающий другой рекомбинантный эритропоэтин.
Данные о применении у пациентов с нарушением функции печени отсутствуют. Т.к. печень считается основным путем выведения дарбэпоэтина альфа и рчЭпо, применение у пациентов с патологией печени следует проводить с осторожностью.
При поддержании уровня гемоглобина у пациентов с хронической почечной недостаточностью, его концентрация не должна превышать указанной верхней границы. В ходе клинических исследований, при достижении целевого уровня гемоглобина более 120 г/л на фоне применения эритропоэз стимулирующих препаратов, у пациентов отмечался повышенный риск смертности и развития серьезных осложнений со стороны сердечно-сосудистой системы. В ходе контролируемых клинических исследований не удалось выявить значительных преимуществ от применения эпоэтинов, если концентрация гемоглобина, превышает уровень, необходимый для контроля симптомов анемии и устранения потребности в гемотрансфузиях.
Осторожность необходима при применении дарбэпоэтина альфа у пациентов с эпилепсией. Имеются сообщения о возникновении судорог на фоне терапии дарбэпоэтином альфа.
Применение дополнительной терапии препаратами железа рекомендуется всем пациентам, у которых концентрация ферритина в сыворотке не превышает 100 мкг/л или уровень насыщения трансферрина ниже 20%.
У пациентов с хронической почечной недостаточностью и клиническими симптомами ИБС или застойной сердечной недостаточности, целевые уровни гемоглобина следует определять индивидуально. У таких больных максимальное содержание гемоглобина не должно превышать 120 г/л, за исключением случаев, когда тяжесть симптомов (например, стенокардия) требует другого решения.
Во время применения дарбэпоэтина альфа следует регулярно контролировать сывороточное содержание калия. При выявлении повышенной или повышающейся концентрации калия, введение дарбэпоэтина альфа следует прекратить до ее нормализации.
Влияние на рост опухоли
Эритропоэтины представляют собой факторы роста, которые, главным образом, стимулируют выработку эритроцитов. Рецепторы к эритропоэтину могут экспрессироваться на поверхности различных опухолевых клеток. Как и в случае любых факторов роста, существует предположение о том, что эритропоэтины способны стимулировать рост опухолей.
В ряде контролируемых клинических исследований у онкологических больных, получающих химиотерапию, применение эпоэтинов не увеличивало общую продолжительность жизни или не снижало риск прогрессии опухоли у пациентов с анемией, ассоциированной с онкологическим заболеванием.
В контролируемых клинических исследованиях дарбэпоэтина альфа и других эритропоэз-стимулирующих препаратов было показано:
— уменьшение времени до прогрессирования у пациентов с запущенным раком головы и шеи, получающими лучевую терапию, при корректирующем назначении эпоэтина до достижения целевого уровня гемоглобина более чем 140 г/л. Применение эритропоэз-стимулирующих препаратов у таких пациентов не показано;
— уменьшение общей продолжительности жизни и повышение смертности, связанное с прогрессией заболевания за 4 месяца у пациентов с метастазирующим раком молочной железы, получавших химиотерапию, при корректирующем назначении эпоэтина до достижения целевого значения гемоглобина 120 -140 г/л;
— повышение риска смерти при корректирующем назначении эпоэтина до достижения целевого значения гемоглобина 120 г/л у пациентов с активной злокачественной опухолью, не получавших ни химиотерапии, ни лучевой терапии. Применение эритропоэз-стимулирующих препаратов у таких больных не показано.
В соответствии с вышеизложенным, в некоторых клинических ситуациях для лечения анемии у пациентов с онкологическими заболеваниями следует применять переливание крови. Решение о назначении рекомбинантных эритропоэтинов следует принимать на основании оценки соотношения польза/риск для каждого индивидуального пациента, принимая во внимание особенности клинической ситуации. Необходимо учитывать следующие факторы: вид и стадия опухолевого процесса; степень анемии; ожидаемая продолжительность жизни; обстановка, в которой пациент будет проходить лечение; и пожелания самого пациента.
У пациентов с солидными опухолями или с лимфопролиферативными злокачественными заболеваниями при возрастании уровня содержания гемоглобина выше 120 г/л следует строго соблюдать рекомендуемую схему коррекции дозы с целью минимизации потенциального риска развития тромбоэмболических явлений. Также необходимо регулярно контролировать численность тромбоцитов и концентрацию гемоглобина в крови.
Инструкция для пациента
Техника процедуры инъекции препарата Дарбэстим® в предварительно заполненных шприцах или в предварительно заполненных шприцах с защитным устройством для иглы
Этот раздел описывает процедуру инъекции препарата Дарбэстим®, которую вы можете выполнить самостоятельно. Перед началом применения препарата в предварительно заполненных шприцах и предварительно заполненных шприцах с защитным устройством для иглы, пожалуйста, сначала ознакомьтесь с «Общими рекомендациями», приведенными ниже (раздел 1), а затем, с рекомендациями, приведенными в разделе 2.Раздел 1. Общие рекомендации
Очень важно, чтобы Вы не делали инъекцию сами, пока ваш лечащий врач, медицинская сестра или провизор не научит Вас. Если у Вас будут вопросы, то проконсультируйтесь с Вашим врачом, медицинской сестрой.
Перед началом инъекции
Внимательно прочитайте все рекомендации перед введением препарата.
Как Вам или тому, кто делает вам эту инъекцию, использовать ПЗШ?
Ваш врач назначил Вам препарат Дарбэстим® для подкожных инъекций. Ваш лечащий врач, медицинская сестра или провизор расскажет Вам какое количество препарата и как часто необходимо вводить.
Оборудование
Для самостоятельных инъекций вам потребуется:
- Один шприц (ПЗШ)/ ПЗШ с защитным устройством для иглы с препаратом Дарбэстим®;
- Спиртовая салфетка.
Перед проведением инъекции
- Достать шприц из холодильника. Для извлечения предварительно заполненного шприца из пачки, возьмитесь за центр прозрачного защитного устройства для иглы.

- Оставить шприц при комнатной температуре примерно на 30 минут. Это позволит сделать инъекцию более комфортной.
- Пожалуйста, обратите внимание на следующие инструкции:
- Не подогревать предварительно заполненный шприц в горячей воде или в микроволновой печи.
- Не оставлять заполненный шприц под солнечными лучами.
- Не брать заполненный шприц за шток поршня, серый колпачок иглы или усики защитного устройства для иглы.
- Не встряхивать шприц.
- Не удалять колпачок предварительно заполненного шприца до тех пор, пока Вы не готовы к инъекции
- Не пытайтесь активировать предварительно заполненный шприц перед инъекцией.
- He пытайтесь снять прозрачное защитное устройство для иглы с предварительно заполненного шприца.
- Перед использованием необходимо проверить следующее:
- Вы используете тот препарат и ту дозу, которые Вам назначил лечащий врач.
- Срок годности на этикетке предварительно заполненного шприца (ГОДЕН ДО:).
Не использовать шприц, если истек последний день указанного месяца. - Описание препарата Дарбэстим®. Раствор должен быть прозрачным или бесцветным или. Если раствор мутный или содержит частицы, препарат использовать нельзя.
- Вы можете заметить маленькие пузырьки воздуха в предварительно заполненном шприце. Вам не нужно удалять пузырьки воздуха перед инъекцией. Введение раствора с пузырьками воздуха является безопасным.
- Тщательно вымыть руки.
- Выбрать комфортное, хорошо освещенное место и чистую поверхность, удобно расположить все необходимые материалы.
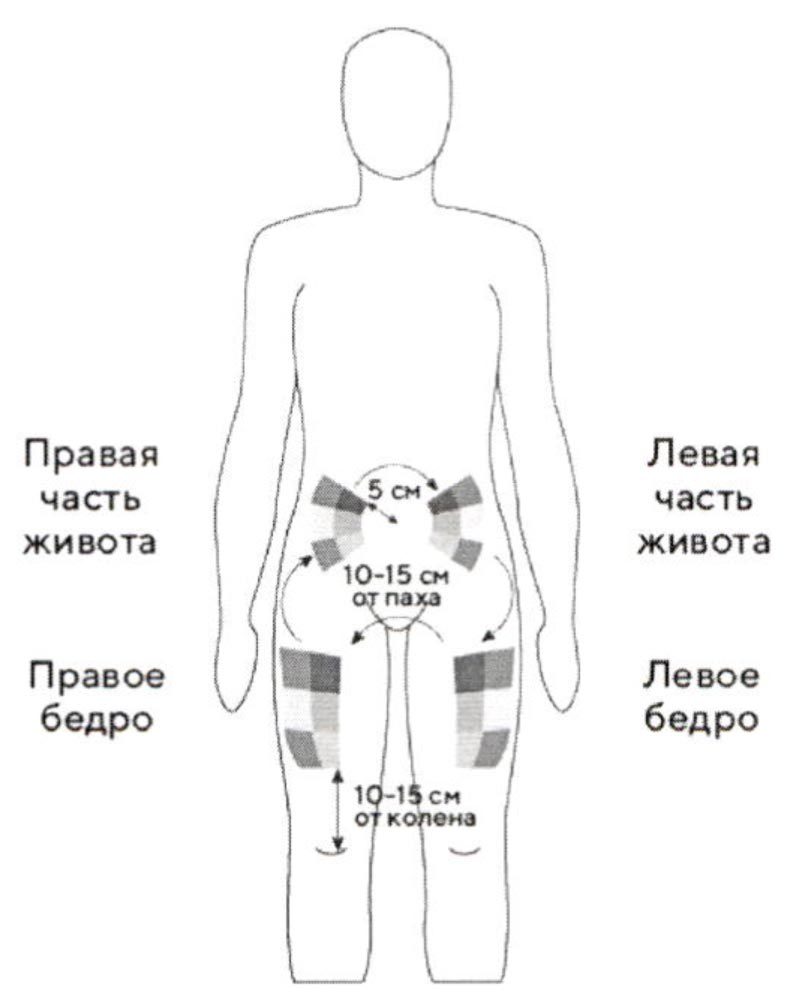
Лучше всего делать инъекции в верхнюю часть бедер и живота. Если инъекции Вам делает кто-то другой, можно использовать тыльную поверхность рук.
Если область, куда Вы собрались делать инъекцию, покраснела или отекла, следует выбрать другое место инъекции.
Раздел 2. Рекомендации по введению препарата Дарбэстим®
Как подготовиться к инъекции?
Перед инъекцией Вы должны сделать следующее:
- Во избежание изгиба иглы, осторожно потянуть колпачок с иглы сразу, без скручивания, как показано на рисунках 1 и 2.
- Не дотрагиваться до иглы и не нажимать на поршень.
- Теперь Вы можете использовать предварительно заполненный шприц.
Как вводить препарат?
- Продезинфицировать место инъекции с помощью спиртовой салфетки, и зажать кожу (не сдавливая) большим и указательным пальцами.
- Ввести иглу в кожу полностью так, как показывал врач или медицинская сестра.
- Ввести назначенную дозу подкожно, как показывал Ваш врач или медицинская сестра.
- Медленно и непрерывно надавливать на поршень, при этом сжимать кожную складку и не отпускать ее, пока шприц не опустеет.
- Извлечь иглу и отпустить складку кожи.
- Если выступит кровь, аккуратно вытереть ее спиртовой салфеткой. Не растирать место инъекции. При необходимости, можно заклеить его пластырем.
- Один предварительно заполненный шприц предназначен для однократного применения. Не использовать оставшийся в шприце препарат Дарбэстим®.
В случае введения препарат Дарбэстим® в предварительно заполненном шприце с защитным устройством для иглы, Вам надо знать, что каждый шприц оснащен предохранителем иглы, который активируется автоматически для закрытия иглы после завершения инъекции.
Как вводить препарат Дарбэстим® в предварительно заполненном шприце с защитным устройством для иглы?
- Очистить кожу с помощью спиртовой салфетки.
- Во избежание загиба иглы, острожное потянуть колпачок с иглы сразу. Не дотрагиваться до иглы и не нажимать на поршень.
- Зажать кожу (не сдавливая) большим и указательным пальцами. Ввести иглу в кожу.
- Надавливать на поршень с легким непрерывным давлением. Надавливать на поршень следует до тех пор, пока шприц не опустеет. Прозрачный предохранитель иглы не сработает, пока предварительно заполненный шприц не опустеет. Пока поршень нажат, удалите иглу из кожи, отпустите поршень и позвольте шприцу подняться вверх до тех пор, пока вся игла не покроется прозрачным защитным устройством для иглы. Если защитное устройство для иглы не активизировалось, возможно, что Вы не выполнили инъекцию полностью. Позвоните Вашему лечащему врачу, если Вы считаете, что Вы не получили полную дозу.
- Если выступит кровь, аккуратно вытереть ее спиртовой салфеткой. Не растирать место инъекции. При необходимости, можно заклеить его пластырем.



1 отзыв
Внимание! Перед употреблением проконсультируйтесь с врачом. Вся информация размещенная на Сайте является исключительно личным мнением Пользователей или Администрации Сайта