
Дупиксент® (Dupixent)
Фармакологические группы:
Международный классификатор болезней (МКБ-10):
Состав и форма выпуска
Раствор для п/к введения прозрачный или слегка опалесцирующий, бесцветный или желтоватого цвета.
| 1 мл | 1 шприцa | |
| дупилумаб | 150 мг | 300 мг |
Вспомогательные вещества: L-гистидин и L-гистидина гидрохлорида моногидрат - 3.1 мгc, L-аргинина гидрохлорид - 4.35 мгd, натрия ацетата тригидрат и уксусная кислота ледяная - 0.75 мгf, сахароза - 50 мгg, полисорбат 80 - 2 мгh, вода д/и - до 1 мл.
2 мл - шприцы одноразовые (1) - пачки картонные с заклеенными клапанами.
2 мл - шприцы одноразовые (2) - пачки картонные с заклеенными клапанами.
2 мл - шприцы одноразовые (2) - упаковки картонные промежуточные (3) - пачки картонные с заклеенными клапанами.
2 мл - шприцы с системой защиты из прозрачного стекла (тип I) (1) - пачки картонные с заклеенными клапанами.
2 мл - шприцы с системой защиты из прозрачного стекла (тип I) (2) - пачки картонные с заклеенными клапанами.
2 мл - шприцы с системой защиты из прозрачного стекла (тип I) (2) - упаковки картонные промежуточные (3) - пачки картонные с заклеенными клапанами.
На каждую пачку картонную нанесен анти контрафактный стикер.
a В расчете на 2 мл препарата.
c Содержание L-гистидина и L-гистидина гидрохлорида приведено в пересчете на L-гистидин (М=155.16 г/моль), исходя из общей концентрации гистидина в препарате 20 мМ.
d Содержание L-аргинина гидрохлорида приведено в пересчете на L-аргинин (М=174,2 г/моль), исходя из молярной концентрации L-аргинина в препарате 25 мМ. Номинальное содержание L-аргинина гидрохлорида (М=210.66 г/моль) в одном шприце составляет 10.5 мг.
f Содержание натрия ацетата тригидрата и уксусной кислоты ледяной приведено исходя из общей концентрации ацетат иона в препарате 12.5 мМ.
g Содержание сахарозы приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации сахарозы в препарате 5%.
h Содержание полисорбата 80 приведено в пересчете на миллиграммы, исходя из масса-объемной концентрации полисорбата 80 в препарате 0.2%.
Фармакологическое действие
Рекомбинантное человеческое моноклональное антитело (IgG4), которое блокирует передачу сигналов интерлейкина-4 (ИЛ-4) и интерлейкина-13 (ИЛ-13) путем специфического связывания с IL-4Rα-субъединицей, общей для рецепторных комплексов ИЛ- 4 и ИЛ-13. Блокирует передачу сигналов ИЛ-4 через рецепторы I типа (IL-4Rα/γc) и общую передачу сигналов ИЛ-4 и ИЛ-13 через рецепторы II типа (IL-4Rα/IL-13Rα). ИЛ-4 и ИЛ-13 являются ключевыми цитокинами воспаления 2-го типа (в т.ч. продуцируемые и Тh2-лимфоцитами), вовлеченными в патогенез атопических заболеваний.
Воспаление 2-го типа играет важную роль в патогенезе многих атопических заболеваний, включая бронхиальную астму, способствует ограничению воздушного потока и увеличивает риск обострений. ИЛ-4 и ИЛ-13 выступают в качестве основных факторов воспаления 2-го типа, активируя множественные типы клеток (например, тучные клетки, лимфоциты, эозинофилы, нейтрофилы, макрофаги) и индуцируя множественные медиаторы (например, иммуноглобулин Е, гистамин, эйкозаноиды, лейкотриены, хемокины и цитокины, включая эотаксин/CCL11, TARC/CCL17 и ИЛ-5), участвующие в воспалении 2-го типа. Блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом у пациентов снижает концентрации многих из этих маркеров воспаления 2-го типа, включая иммуноглобулин Е, периостин и множественные провоспалительные цитокины и хемокины (например, эотаксин, TARC), а также снижает уровень фракции оксида азота в выдыхаемом воздухе (FeNO) - маркер воспаления в легких. Было показано, что блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом в гуманизированных моделях животных предотвращает последующие действия этих цитокинов и хемокинов, в т.ч. гиперплазию бокаловидных клеток, гиперреактивность гладкомышечных клеток дыхательных путей, эозинофильное воспаление в легких, другие воспалительные процессы в легких, а также предотвращает нарушение функции легких; при этом снижение выраженности эозинофильного воспаления в легких происходит независимо от нормального или повышенного уровня эозинофилов в крови.
Дупилумаб производится с помощью технологии рекомбинантной ДНК в суспензионной культуре клеток яичника китайского хомячка. Дупилумаб имеет молекулярную массу приблизительно 147 кДа.
Показания
- Атопический дерматит среднетяжелого и тяжелого течения у взрослых пациентов при недостаточном ответе на терапию топическими лекарственными препаратами или в случае, когда такие препараты не рекомендованы к применению. Можно применять в качестве монотерапии или одновременно с топическими лекарственными препаратами.
- В качестве дополнительной поддерживающей терапии бронхиальной астмы среднетяжелого и тяжелого течения у пациентов в возрасте 12 лет и старше с эозинофильным фенотипом или у пациентов с гормонально зависимой бронхиальной астмой, получающих пероральные ГКС.
Режим дозирования
Препарат вводят п/к.
Атопический дерматит
Рекомендуемая доза препарата Дупиксент® у взрослых пациентов:
начальная доза - 600 мг (2 инъекции по 300 мг), далее - по 300 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг еженедельно.
Бронхиальная астма
Рекомендуемая доза препарата Дупиксент® у взрослых пациентов и детей (12 лет и старше):
начальная доза - 400 мг (2 инъекции по 200 мг), далее - по 200 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг каждые 2 недели;
начальная доза - 600 мг (2 инъекции по 300 мг), далее - по 300 мг каждые 2 недели для пациентов с глюкокортикостероидозависимой бронхиальной астмой или сопутствующим среднетяжелым или тяжелым атопическим дерматитом, при котором показано применение препарата Дупиксент®.
В случае пропуска дозы пациент должен получить инъекцию как можно скорее и затем продолжить лечение в соответствии с назначенным ему режимом введения препарата.
Безопасность и эффективность препарата Дупиксент® у детей и подростков в возрасте до 18 лет с атопическим дерматитом не установлена.
Безопасность и эффективность препарата Дупиксент® у детей в возрасте до 12 летс бронхиальной астмой не установлена.
У пациентов пожилого возраста коррекции дозы не требуется.
Отсутствуют данные по применению препарата у пациентов с печеночной недостаточностью.
У пациентов с легкой или средней степенью тяжести почечной недостаточности коррекции дозы не требуется. Отсутствуют данные по применению препарата у пациентов с тяжелой почечной недостаточностью.
Не требуется коррекции режима дозирования в зависимости от массы тела пациента.
Способ применения
Перед введением препарата следует осмотреть его на предмет наличия в растворе твердых частиц или появления нехарактерной окраски раствора. Если в препарате содержатся твердые частицы или у раствора появилась нехарактерная окраска, вводить препарат нельзя.
Раствор в предварительно заполненном шприце с системой защиты или предварительно заполненном шприце перед проведением инъекции препарата Дупиксент® должен нагреться до комнатной температуры. Для этого рекомендуется выдержать его при комнатной температуре в течение 45 мин (для дозировки 300 мг) или 30 мин (для дозировки 200 мг).
В случае необходимости предварительно заполненный шприц можно хранить при комнатной температуре (до 25°С) в течение максимум 14 дней. Препарат нельзя хранить при температуре выше 25°С. После извлечения из холодильника Дупиксент® следует использовать в течение 14 дней или утилизировать.
Шприцы следует защищать от нагревания и воздействия прямого солнечного света.
Если начальная доза составляет 600 мг, следует сделать две инъекции по 300 мг в разные места для инъекций.
Если начальная доза составляет 400 мг, следует сделать две инъекции по 200 мг в разные места для инъекций.
Лечение препаратом Дупиксент® следует проводить под медицинским наблюдением. Инъекцию препарата может делать себе либо сам пациент, либо лицо, ухаживающее за ним.
Необходимо до начала применения препарата Дупиксент® обучить пациентов и/или ухаживающих за ними лиц подготовке и проведению инъекции препарата Дупиксент®, согласно указаниям в "Инструкции по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце с системой защиты", "Инструкции по подготовке и проведению инъекции препарата Дупиксент®, 300 мг в предварительно заполненном одноразовом шприце" и "Инструкции по подготовке и проведению инъекции препарата Дупиксент®, 200 мг в предварительно заполненном одноразовом шприце с системой защиты".
Препарат Дупиксент® может вводиться самим пациентом п/к с помощью предварительно заполненного одноразового шприца в область бедра или живота, за исключением области диаметром 5 см непосредственно вокруг пупка. Если инъекцию проводит другой человек, препарат также можно вводить в верхнюю часть плеча.
Рекомендуется менять места инъекций при каждом введении препарата.
Инъекцию препарата Дупиксент® не следует проводить в участки с болезненной и поврежденной кожей, в места с кровоподтеками или рубцами.
Все остатки неиспользованного препарата и расходные материалы необходимо утилизировать в соответствии с требованиями местного законодательства.
Инструкция по подготовке и проведению инъекции препарата Дупиксент®300 мг в предварительно заполненном одноразовом шприце с системой защиты
Перед началом применения препарата Дупиксент® в предварительно заполненном одноразовом шприце с системой защиты внимательно прочитайте эту инструкцию.
Элементы предварительно заполненного одноразового шприца с системой защиты показаны на рисунке ниже:

Данное устройство представляет собой предварительно заполненный одноразовый шприц с системой защиты (далее называется "шприц"). В нем содержится раствор для п/к введения, содержащий 300 мг препарата Дупиксент®.
Важная информация:
не пытайтесь провести инъекцию самостоятельно или с помощью кого-то до тех пор, пока лечащий врач или медицинский работник не обучат Вас правильной технике проведения подкожной инъекции;
перед использованием шприца внимательно прочитайте информацию по его использованию;
узнайте у своего лечащего врача, как часто необходимо проводить инъекции препарата Дупиксент®;
попросите своего лечащего врача или медицинского работника показать, как правильно пользоваться шприцем, перед тем как в первый раз самостоятельно провести инъекцию препарата Дупиксент®;
рекомендуется менять место инъекции при каждом введении препарата;
не используйте шприц, если он упал на твердую поверхность или поврежден;
нельзя использовать шприц, если отсутствует колпачок иглы, или он не был надежно зафиксирован;
не дотрагивайтесь до штока поршня до тех пор, пока не будете готовы провести инъекцию;
не проводите инъекции через одежду;
не пытайтесь удалить воздушные пузырьки из шприца;
для того чтобы снизить риск случайного укола иглой, каждый предварительно заполненный одноразовый шприц оборудован устройством безопасности с системой защиты, которое автоматически активируется, закрывая иглу, после того, как проведена инъекция;
не тяните шток поршня назад;
шприц не подлежит повторному использованию.
Как хранить шприц:
храните шприцы в недоступном для детей месте;
храните неиспользуемые шприцы в оригинальной картонной упаковке в холодильнике при температуре от 2°C до 8°C;
после извлечения из холодильника шприц следует оставить на 45 мин при комнатной температуре и дать возможность ему нагреться перед тем, как делать инъекцию препарата Дупиксент®;
шприцы можно хранить при комнатной температуре в течение не более чем 14 дней;
не встряхивайте шприц;
не подвергайте шприц тепловому воздействию;
не замораживайте шприц;
не допускайте воздействия на шприц прямых солнечных лучей.
Шаг 1. Извлечение шприца из упаковки
Извлеките шприц из картонной упаковки, взяв его за середину корпуса.
Не снимайте колпачок иглы до момента проведения инъекции.
Нельзя использовать шприц, если он упал на твердую поверхность или поврежден.
Шаг 2. Подготовка
Убедитесь, что в наличии есть все необходимое для проведения инъекции:
предварительно заполненный шприц;
1 салфетка, смоченная спиртом*;
1 ватный тампон или марлевая салфетка*;
устойчивый к проколам контейнер* (см. Шаг 12).
* Не содержатся в картонной упаковке.
Внимательно проверьте маркировку:
проверьте дату истечения срока годности;
убедитесь в том, что у Вас правильный препарат и правильная доза.
Нельзя использовать шприц после истечения срока годности, указанного на этикетке.

Шаг 3. Проверка
Осмотрите раствор через смотровое окно на шприце: проверьте, является ли раствор прозрачным, является ли жидкость бесцветной или имеющей светло-желтый оттенок.
Примечание: Вы можете обнаружить воздушные пузырьки, это нормально.
Нельзя использовать шприц, если жидкость изменила цвет или помутнела, или если в ней есть заметные хлопья или частицы.

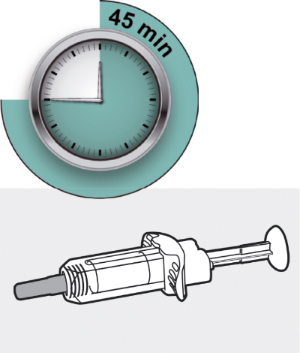
Шаг 4. Подождите 45 мин
Положите шприц на плоскую поверхность не менее чем на 45 мин, пусть шприц нагреется до комнатной температуры.
Не нагревайте шприц.
Не подвергайте шприц прямому воздействию солнечных лучей.
Шприц нельзя хранить при комнатной температуре более 14 дней.
Шаг 5. Выбор места инъекции
Выберите место инъекции:
инъекцию можно сделать в наружную поверхность бедра или в переднюю часть живота, за исключением области диаметром 5 см непосредственно вокруг пупка;
если инъекцию осуществляет другой человек, для инъекции также можно использовать участок кожи в верхней части плеча.
Инъекции препарата Дупиксент® не следует осуществлять на участках с болезненной или поврежденной кожей, кровоподтеками или рубцами.

Шаг 6. Обработка места инъекции
Вымойте руки.
Протрите участок кожи, предназначенный для инъекции салфеткой, смоченной спиртом.
Дайте коже высохнуть перед проведением инъекции.
Не дотрагивайтесь до обработанного участка кожи руками и не дуйте на него перед проведением инъекции.

Шаг 7. Удаление колпачка иглы
Держите шприц за середину корпуса, игла должна быть направлена в сторону от Вас; снимите колпачок с иглы.
Не надевайте колпачок обратно на иглу.
Не касайтесь иглы.
Лекарственный препарат необходимо ввести сразу же после удаления колпачка иглы.

Шаг 8. Формирование складки кожи
Сформируйте складку кожи в месте инъекции, как показано на рисунке.

Шаг 9. Введение иглы
Полностью введите иглу в сформированную складку кожи под углом приблизительно 45°.

Шаг 10. Введение раствора
Ослабьте сформированную складку кожи.
Медленно и непрерывно нажимайте на шток поршня для введения всего раствора, пока шприц не опустеет.
Примечание: Вы почувствуете некоторое сопротивление. Это нормально.

Шаг 11. Завершение инъекции и извлечение иглы
Поднимите большой палец, снимая давление со штока поршня, игла будет втянута внутрь защитного колпачка для иглы; затем удалите шприц из места инъекции.
Слегка прижмите ватный тампон или марлевую салфетку к месту инъекции, если заметите кровь.
Не надевайте колпачок иглы снова на иглу.
Не растирайте кожу после инъекции.

Шаг 12. Утилизация
После использования следует поместить шприц и колпачок иглы в устойчивый к проколам контейнер.
Не надевайте колпачок иглы снова на иглу.
Храните контейнер в недоступном для детей месте.

Противопоказания к применению
Повышенная чувствительность к дупилумабу; детский возраст до 18 лет у пациентов с атопическим дерматитом среднетяжелого и тяжелого течения; детский возраст до 12 лет у пациентов с бронхиальной астмой среднетяжелого и тяжелого течения.
Применение при беременности и кормлении грудью
При беременности возможно применение только в случаях, когда ожидаемая польза терапии для матери превышает потенциальный риск для плода.
Неизвестно, выделяется ли дупилумаб с грудным молоком у человека. Следует, с учетом пользы грудного вскармливания для ребенка и преимущества дальнейшего применения препарата для матери, принят решение о прекращении кормления грудью или отмене дупилумаба в течение периода грудного вскармливания
Применение при нарушениях функции печени
У пациентов с легкой или средней степенью тяжести почечной недостаточности коррекции дозы не требуется. Отсутствуют данные по применению препарата у пациентов с тяжелой почечной недостаточностью.
Применение при нарушениях функции почек
Отсутствуют данные по применению препарата у пациентов с печеночной недостаточностью.
Применение у детей
Противопоказания: детский возраст до 18 лет у пациентов с атопическим дерматитом среднетяжелого и тяжелого течения; детский возраст до 12 лет у пациентов с бронхиальной астмой среднетяжелого и тяжелого течения.
Применение у пожилых пациентов
У пациентов пожилого возраста коррекции дозы не требуется.
Побочные действия
Инфекционные заболевания: часто - герпес ротовой полости, простой герпес.
Со стороны системы кроветворения: часто - эозинофилия.
Со стороны органа зрения: часто - конъюнктивит, в т.ч. аллергический, бактериальный; зуд в глазах, блефарит, синдром "сухого" глаза.
Аллергические реакции: очень редко - анафилаксия.
Местные реакции: очень часто - реакции в месте инъекции, эритема; часто - отек, зуд в месте инъекции.
Взаимодействие
Живые вакцины
Применение препарата Дупиксент® с живыми вакцинами не изучалось. Во время лечения препаратом Дупиксент® не следует проводить вакцинацию живыми вакцинами.
Неживые (инактивированные) вакцины
Иммунные реакции на вакцинацию изучались в исследовании, в котором пациенты с атопическим дерматитом получали еженедельно препарат Дупиксент® в дозе 300 мг в течение 16 недель. После 12 недель терапии дупилумабом пациентов вакцинировали вакциной Tdap (Т-клеточно-зависимая, Adacel®) и менингококковой полисахаридной вакциной (Т-клеточно-независимая, Menomune®) и оценивали иммунные реакции по истечении 4 недель. У пациентов, получавших как дупилумаб, так и плацебо, реакции с образованием антител к противостолбнячной и менингококковой полисахаридной вакцинам были сходными. В этом исследовании не было обнаружено нежелательного взаимодействия между любой из этих неживых вакцин и дупилумабом.
Взаимодействие с субстратами изоферментов CYP450
В клиническом исследовании, проведенном у пациентов с атопическим дерматитом, оценивались эффекты дупилумаба на фармакокинетику субстратов изоферментов CYP. Данные, полученные в этом исследовании, не указывают на клинически значимое влияние дупилумаба на активность изоферментов CYP1A2, CYP3A, CYP2C19, CYP2D6 или CYP2C9.
Взаимодействие с другими лекарственными средствами для лечения бронхиальной астмы
Влияние дупилумаба на фармакокинетику одновременно назначаемых препаратов не ожидается. Данные, полученные на основании популяционного анализа, не указывают на влияние одновременно назначаемых препаратов на фармакокинетику дупилумаба у пациентов со среднетяжелым или тяжелым течением бронхиальной астмы.
Условия хранения
При температуре 2–8 °C (не замораживать). (в оригинальной упаковке)
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Производитель
SANOFI WINTHROP INDUSTRIE (Франция) или COOK PHARMIKA, LLC (США)
Условия отпуска из аптек
Препарат отпускается по рецепту.
Фармакокинетика
Фармакокинетика дупилумаба аналогична у пациентов с атопическим дерматитом и бронхиальной астмой.
После однократного п/к введения дупилумаба в дозе 75-600 мг медиана Тmах составляла 3-7 дней. Абсолютная биодоступность дупилумаба после п/к введения сходна между пациентами с атопическим дерматитом и бронхиальной астмой и составляет 61-64% (установлена при популяционном фармакокинетическом анализе).
Введение однократной нагрузочной дозы в первый день приводит к быстрому достижению клинически эффективных концентраций в течение 2 недель.
При схеме лечения 200 мг или 300 мг 1 раз в 2 недели, начиная с нагрузочной дозы 400 мг или 600 мг, Css обычно достигаются в среднем к 16-й неделе лечения. В равновесном состоянии средняя остаточная концентрация перед
введением следующей дозы составляла 39 мг/л при применении 200 мг 1 раз в 2 нед. и 70-74 мг/л при применении 300 мг 1 раз в 2 нед.
При еженедельном п/к введении дупилумаба 300 м, начиная с нагрузочной дозы 600 мг, Css обычно достигаются в среднем после 13 недель лечения. В состоянии достижения равновесных концентраций средняя остаточная концентрация перед
введением следующей дозы составляла 189 мг/л.
Из-за нелинейности клиренса системная экспозиция дупилумаба, определяемая по значению AUC, увеличивается быстрее, непропорционально увеличению дозы после однократного п/к введения в дозах от 75 мг до 600 мг.
Vd дупилумаба составляет приблизительно 4.6 л, что указывает на его распределение главным образом в сосудистой системе.
Предполагается, что дупилумаб расщепляется до низкомолекулярных пептидов и отдельных аминокислот.
Выведение дупилумаба осуществляется параллельно линейными и нелинейными путями. При более высоких концентрациях выведение дупилумаба осуществляется главным образом через не насыщаемый протеолитический путь, в то время как при более низких концентрациях выведение преимущественно осуществляется через нелинейное насыщаемое связывание с мишенью IL-4Rα.
После введения последней дозы в равновесном состоянии медиана времени до неопределяемых концентраций дупилумаба, составляет 9 недель при введении 200 мг 1 раз/2 нед., 10-11 недель при введении 300 мг 1 раз/2 нед. и 13 недель при введении 300 мг 1 раз/нед.
Передозировка
В клинических исследованиях не было выявлено проблем, связанных с безопасностью, при однократном в/в введении в дозах до 12 мг/кг.
Лечение: специфического антидота при передозировке препаратом Дупиксент® не существует. В случае передозировки необходимо контролировать состояние пациента для своевременного выявления признаков и симптомов нежелательных явлений и незамедлительно назначать соответствующее симптоматическое лечение.
Особые указания
При возникновении системной реакции гиперчувствительности лечение средством следует немедленно прекратить, и начать соответствующую терапию. Сообщалось об одном случае развития реакции, подобной сывороточной болезни, и об одном случае развития сывороточной болезни после применения дупилумаба. При применении средства при бронхиальной астме сообщалось об одном случае развития анафилаксии.
Конъюнктивит чаще отмечался у пациентов с атопическим дерматитом, получавших дупилумаб. Большинство пациентов с конъюнктивитом выздоровели или выздоравливали в течение периода лечения. Среди пациентов с бронхиальной астмой частота конъюнктивита была низкой. Следует рекомендовать пациентам незамедлительно сообщать о первом появлении или ухудшении симптомов со стороны глаз своему лечащему врачу.
У пациентов с бронхиальной астмой может развиться серьезная системная эозинофилия, иногда в виде клинических признаков эозинофильной пневмонии или васкулита, соответствующих эозинофильному гранулематозу с полиангиитом, которые часто лечатся системными кортикостероидами. Эти события, как правило, но не всегда, могут быть связаны с сокращением приема пероральных кортикостероидов. Врачи должны быть внимательны к васкулитной сыпи, ухудшающимся легочным симптомам, сердечным осложнениям и/или нейропатии, возникающим у их пациентов с эозинофилией. Имеются сообщения о случаях эозинофильной пневмонии и васкулита, соответствующих эозинофильному гранулематозу с полиангиитом, при применении дупилумаба. Связь между применением дупилумаба и этими состояниями не была установлена.
Средство не следует назначать для лечения симптомов остро возникшего ухудшения или обострений астмы. Дупилумаб не применяют для лечения острого бронхоспазма или астматического статуса.
Не следует резко прерывать применение системных, местных или ингаляционных ГКС после начала терапии дупилумабом. Сокращение дозы глюкокортикостероидов, при необходимости, должно быть постепенным и должно выполняться под непосредственным наблюдением врача. Уменьшение дозы ГКС может сопровождаться системными симптомами отмены и/или манифестацией состояний, которые ранее не проявлялись из-за системной терапии ГКС.
Неизвестно, может ли дупилумаб повлиять на иммунный ответ при гельминтозах. Необходимо провести лечение пациентов с имеющимся гельминтозом перед тем, как начинать лечение дупилумабом. Если во время лечения пациент заражается гельминтозом, а антигельминтные препараты оказываются неэффективными, следует прекратить лечение дупилумабом до излечения паразитарного заболевания.
Пациентам с атопическим дерматитом и с сопутствующей бронхиальной астмой следует рекомендовать не изменять своего лечения, не проконсультировавшись с лечащим врачом. Прекращая лечение дупилумабом, следует принимать во внимание возможные эффекты на течение других атопических заболеваний.

1 отзыв
Внимание! Перед употреблением проконсультируйтесь с врачом. Вся информация размещенная на Сайте является исключительно личным мнением Пользователей или Администрации Сайта