Фармакологические группы:
Международный классификатор болезней (МКБ-10):
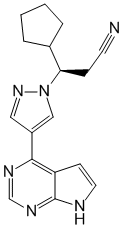
Химическое название
Фармакология
Фармакодинамика
Руксолитиниб является селективным ингибитором JAK-киназ (Janus Associated Kinases — JAKs) — JAK1 и JAK2. Данные киназы способствуют передаче сигналов от многочисленных цитокинов и факторов роста, играющих важную роль в гемопоэзе и функции иммунной системы.
Активированные JAK-киназы, воздействуя на цитокиновые рецепторы, активируют STAT-белки (STATs) (переносчики сигнала и активаторы транскрипции), которые в результате активации транспортируются внутрь ядра и модулируют экспрессию генов. Дисрегуляция пути JAK-STAT ассоциирована с некоторыми видами злокачественных новообразований и увеличением пролиферации и выживаемости злокачественных клеток.
Миелофиброз и истинная полицитемия — миелопролиферативные заболевания, связанные с дисрегуляцией сигнального пути JAK1 и JAK2. Как полагают, основой дисрегуляции является высокий уровень циркулирующих цитокинов, которые активируют путь JAK-STAT, приводя к патологическим функциональным мутациям, таким как JAK2V617F, и к подавлению отрицательных регуляторных механизмов. У пациентов с миелофиброзом обнаруживается дисрегуляция сигнального пути JAK, независимо от наличия мутации JAK2V617F. Активирующие мутации сигнального пути JAK2 (V617F или экзона 12) обнаруживаются у >95% пациентов с истинной полицитемией.
Руксолитиниб ингибирует цитокининдуцированное фосфорилирование STAT3 в цельной крови как у здоровых добровольцев, так и у пациентов с миелофиброзом или истинной полицитемией. Руксолитиниб приводит к максимальному ингибированию фосфорилирования STAT3 через 2 ч после введения, которое возвращается к исходному показателю через 8 ч у здоровых добровольцев и пациентов с миелофиброзом, что указывает на отсутствие кумуляции как исходного вещества, так и его метаболитов.
Исходное повышение концентрации маркеров воспалительного процесса, таких как ФНО-альфа, ИЛ-6 и С-реактивный белок, наблюдающееся у пациентов с миелофиброзом, снижается после лечения руксолитинибом. У пациентов с миелофиброзом не отмечается формирования резистентности к фармакодинамическим эффектам руксолитиниба. Аналогично у пациентов с истинной полицитемией наблюдается исходное повышение концентрации маркеров воспалительного процесса, снижавшейся после лечения руксолитинибом.
В клиническом исследовании не отмечалось удлинения интервала QT/QTc при применении руксолитиниба однократно в супратерапевтических дозах (200 мг), что указывает на отсутствие влияния на реполяризацию сердца.
Исследование интервала QT. Влияние однократных доз руксолитиниба 25 и 200 мг на интервал QTc было оценено в рандомизированном плацебо- и актив-контролируемом (моксифлоксацин 400 мг) перекрестном всестороннем исследовании с 4 периодами у 47 здоровых добровольцев. В исследовании с доказанной способностью обнаруживать малые эффекты верхняя граница одностороннего 95% ДИ для наибольшего плацебо-скорректированного корригированного интервала QTc с коррекцией по формуле Fridericia (QTcF) была ниже порогового значения 10 мс. Доза 200 мг достаточна для представления клинического сценария при высокой экспозиции.
Фармакокинетика
Абсорбция. Руксолитиниб относится к 1-му классу молекул по биофармацевтической классификационной системе (Biopharmaceutical Classification System) с высокой проницаемостью, высокой растворимостью и быстрым растворением. В клинических исследованиях руксолитиниб быстро всасывался после приема внутрь с Tmах приблизительно 1 ч. Абсорбция руксолитиниба составляет 95% или более. Средняя Сmах и AUC повышаются пропорционально в диапазоне доз от 5 до 200 мг. При применении руксолитиниба одновременно с пищей с высоким содержанием жиров наблюдались клинически незначимые изменения фармакокинетики руксолитиниба: средняя Сmах незначительно снижалась (24%), в то время как AUC практически не изменялась (повышалась на 4%).
Абсорбция. В клинических исследованиях руксолитиниб быстро всасывался после приема внутрь с Tmах в пределах 1–2 ч.
Распределение. Средний Vss составил около 75 л у пациентов с миелофиброзом и истинной полицитемией. В клинически значимых концентрациях связь руксолитиниба с белками in vitro (в основном с альбумином) составила приблизительно 97%. В исследовании у животных было показано, что руксолитиниб не проникает через ГЭБ.
Распределение. Средний Vss составил 72 л у пациентов с миелофиброзом (межиндивидуальная вариабельность — 29%) и 75 л у пациентов с истинной полицитемией (межиндивидуальная вариабельность — 23%).
Биотрансформация/метаболизм. Руксолитиниб является субстратом изофермента CYP3A4. После приема внутрь в крови циркулирует 60% руксолитиниба в неизмененном виде. В крови человека определены 2 основных активных метаболита руксолитиниба, представляющих 25 и 11% AUC. Фармакологическая активность руксолитиниба на 18% складывается из активности его метаболитов. В клинически значимых концентрациях руксолитиниб не ингибирует изоферменты CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 или CYP3A4 и не является сильным индуктором изоферментов CYP1A2, CYP2B6 или CYP3A4.
Метаболизм. В in vitro исследованиях показано, что руксолитиниб метаболизируется посредством изофермента CYP3A4 и в меньшей степени — CYP2C9.
Элиминация. После введения однократной дозы меченого радиоактивной меткой руксолитиниба большая часть (74%) радиоактивности определялась в моче (выводилось почками), и 22% выводилось через кишечник. Неизмененное вещество составило менее чем 1% общего выведенного препарата. T1/2 руксолитиниба составлял приблизительно 3 ч.
Элиминация. После введения однократной дозы меченого 14С-руксолитиниба здоровым взрослым добровольцам 74% радиоактивности выводилось с мочой и 22% — с фекалиями. Неизмененное вещество составило менее 1% общей выведенной радиоактивности. T1/2 руксолитиниба — приблизительно 3 ч и T1/2 руксолитиниб + метаболиты — примерно 5,8 ч.
Линейность/нелинейность фармакокинетики. Фармакокинетика руксолитиниба изменяется пропорционально вводимым (однократно, многократно) дозам.
Фармакокинетика у отдельных групп пациентов
Влияние возраста, пола или расы. Не выявлено значительных различий в фармакокинетике руксолитиниба в зависимости от пола и расы. Клиренс руксолитиниба у пациентов с миелофиброзом составляет 17,7 л/ч у женщин и 22,1 л/ч у мужчин (межиндивидуальная вариабельность — 39%). У пациентов с истинной полицитемией клиренс руксолитиниба составляет 12,7 л/ч (межиндивидуальная вариабельность — 42%); не выявлено влияния пола, возраста или расы на клиренс при приеме ЛС внутрь.
Влияние возраста, пола или расы. У здоровых добровольцев не выявлено значительных различий в фармакокинетике руксолитиниба в зависимости от пола и расы. По оценкам популяционного фармакокинетического анализа, у больных с миелофиброзом не обнаружено изменений перорального клиренса в зависимости от возраста пациента или расы; у женщин клиренс составляет 17,7 л/ч и у мужчин 22,1 л/ч с 39% межиндивидуальной вариабельностью. У больных с истинной полицитемией клиренс — 12,7 л/ч с 42% межиндивидуальной вариабельностью; изменений перорального клиренса в зависимости от пола, возраста пациента или расы в этой популяции пациентов не выявлено.
Пациенты в возрасте ≤18 лет. Эффективность и безопасность руксолитиниба у пациентов младше 18 лет не установлена.
Нарушение функции почек. AUC метаболитов руксолитиниба повышается с увеличением степени тяжести нарушения функции почек и достигает существенных значений у пациентов с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе. Руксолитиниб не выводится посредством диализа. Для пациентов с тяжелой и терминальной стадиями почечной недостаточности (Cl креатинина менее 30 мл/мин) рекомендуется коррекция дозы руксолитиниба.
Нарушение функции печени. AUC руксолитиниба повышалась у пациентов с нарушением функции печени легкой, средней и тяжелой степени тяжести соответственно на 87, 28 и 65% по сравнению с нормальной функцией печени, при этом отсутствует явная взаимосвязь со степенью тяжести нарушения функции печени, определяемой по шкале Чайлд-Пью. Конечный T1/2 удлинен у пациентов с нарушением функции печени по сравнению со здоровыми добровольцами (4,1–5 ч против 2,8 ч). У пациентов с нарушением функции печени рекомендуется снижение дозы руксолитиниба.
Применение при беременности и кормлении грудью
Руксолитиниб противопоказан к применению в период беременности и грудного вскармливания.
Пациенткам фертильного возраста во время терапии руксолитинибом рекомендовано использовать методы контрацепции. В случае наступления беременности во время терапии руксолитинибом необходимо тщательно оценить соотношение польза/риск индивидуально для каждой пациентки, с учетом новейших известных данных об эмбриотоксичности руксолитиниба.
Категория действия на плод по FDA — C.
Адекватные и строго контролируемые исследования руксолитиниба у беременных женщин не проводились. В исследованиях эмбриофетальной токсичности применение руксолитиниба приводило к увеличению поздней резорбции и снижению веса плода при токсичных для материнского организма дозах. Руксолитиниб следует использовать во время беременности только в случае, если ожидаемый эффект терапии превышает потенциальный риск для плода.
Неизвестно, экскретируется ли руксолитиниб в молоко женщин. Руксолитиниб и/или его метаболиты экскретируются в молоко лактирующих крыс в концентрациях, в 13 раз превышающих плазменные в организме самок. Поскольку многие ЛС могут выделяться с грудным молоком и из-за потенциальной возможности тяжелых побочных реакций у младенцев, находящихся на грудном вскармливании, следует принять решение о прекращении грудного вскармливания или отказе от руксолитиниба, принимая во внимание значение ЛС для матери.
Характеристика
Противоопухолевое средство, ингибитор протеинкиназы. Руксолитиниба фосфат — порошок от белого или почти белого до светло-розового цвета, растворяется в водных буферных растворах с рН от 1 до 8.
Применение
Миелофиброз. Лечение пациентов с миелофиброзом, включая первичный миелофиброз и вторичный миелофиброз, развившийся вследствие истинной полицитемии и эссенциальной тромбоцитемии.
Полицитемия истинная. Лечение пациентов с истинной полицитемией, резистентных к терапии препаратами гидроксимочевины или при их непереносимости.
Руксолитиниб противопоказан к применению в период беременности и грудного вскармливания.
Пациенткам фертильного возраста во время терапии руксолитинибом рекомендовано использовать методы контрацепции. В случае наступления беременности во время терапии руксолитинибом необходимо тщательно оценить соотношение польза/риск индивидуально для каждой пациентки, с учетом новейших известных данных об эмбриотоксичности руксолитиниба.
Категория действия на плод по FDA — C.
Адекватные и строго контролируемые исследования руксолитиниба у беременных женщин не проводились. В исследованиях эмбриофетальной токсичности применение руксолитиниба приводило к увеличению поздней резорбции и снижению веса плода при токсичных для материнского организма дозах. Руксолитиниб следует использовать во время беременности только в случае, если ожидаемый эффект терапии превышает потенциальный риск для плода.
Неизвестно, экскретируется ли руксолитиниб в молоко женщин. Руксолитиниб и/или его метаболиты экскретируются в молоко лактирующих крыс в концентрациях, в 13 раз превышающих плазменные в организме самок. Поскольку многие ЛС могут выделяться с грудным молоком и из-за потенциальной возможности тяжелых побочных реакций у младенцев, находящихся на грудном вскармливании, следует принять решение о прекращении грудного вскармливания или отказе от руксолитиниба, принимая во внимание значение ЛС для матери.
Ограничения к применению
Следует соблюдать осторожность при применении руксолитиниба у пациентов с тяжелой почечной недостаточностью и пациентов на гемодиализе, пациентов с печеночной недостаточностью, пациентов с тяжелыми инфекционными заболеваниями в стадии обострения, также у пациентов с тромбоцитопенией, анемией и нейтропенией. Следует соблюдать осторожность при применении руксолитиниба одновременно с сильными ингибиторами изофермента CYP3A4.
Противопоказания
Повышенная чувствительность к руксолитинибу, беременность и период кормления грудью, возраст младше 18 лет.
Побочные действия
Нежелательные явления (НЯ), отмечавшиеся при применении руксолитиниба в ходе клинических исследований
НЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA, в пределах каждой группы перечислены в порядке уменьшения частоты встречаемости.
Для оценки частоты встречаемости использованы следующие критерии (согласно классификации ВОЗ): очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000).
В клинических исследованиях тяжесть НЯ оценивалась согласно Общей терминологии критериев нежелательных явлений:
1 — легкая степень.
2 — средняя степень.
3 — тяжелая степень.
4 — крайне тяжелая (жизнеугрожающая) степень.
Миелофиброз
Инфекционные и паразитарные заболевания: очень часто — инфекции мочевыводящих путей, в частности цистит, уросепсис, пиурия, инфекции почек; часто — опоясывающий герпес; нечасто — туберкулез.
Со стороны крови и лимфатической системы: очень часто — анемия (в т.ч. 3-й степени тяжести (>80–65 г/л), 4-й степени тяжести (<65 г/л), тромбоцитопения, нейтропения, кровотечения, внутричерепные кровоизлияния, подкожные кровоизлияния, синяки, включая ушибы, экхимозы, гематомы, в т.ч. периорбитальная гематома, повышенная склонность с синякам, петехии, пурпура; часто — тромбоцитопения 4-й степени тяжести (<25·109/л), 3-й степени тяжести (50–25·109/л), нейтропения 4-й степени тяжести (<0,5·109/л), 3-й степени тяжести (<1–0,5·109/л).
Со стороны обмена веществ и питания:очень часто — гиперхолестеринемия (1-й, 2-й степени тяжести), увеличение массы тела.
Со стороны нервной системы: очень часто — головокружение, вертиго, головная боль; часто — нарушение равновесия; нечасто — болезнь Меньера.
Со стороны ЖКТ: часто — метеоризм.
Со стороны печени и желчевыводящих путей: очень часто — повышение активности АЛТ, повышение активности ACT; часто — повышение активности АЛТ 3-й степени (в 5–20 раз выше нормы).
При применении руксолитиниба было получено сообщение о случае развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ). При подозрении на развитие ПМЛ следует прекратить применение руксолитиниба.
После прекращения терапии руксолитинибом некоторые пациенты с миелофиброзом испытывали следующие НЯ: лихорадка, респираторный дистресс-синдром, артериальная гипотензия, ДВС-синдром или полиорганная недостаточность.
Истинная полицитемия
Инфекционные и паразитарные заболевания: часто — назофарингит, опоясывающий герпес, инфекции мочевыводящих путей.
Со стороны крови и лимфатической системы: очень часто — анемия, тромбоцитопения; часто — тромбоцитопения 3-й степени тяжести (50–25·109/л); нечасто — анемия 3-й степени тяжести (>80–65 г/л), 4-й степени тяжести (<65 г/л), тромбоцитопения 4-й степени тяжести (<25·109/л).
Со стороны обмена веществ и питания: очень часто — гиперхолестеринемия (1-й, 2-й степени тяжести), гипертриглицеридемия (1-й степени тяжести); часто — увеличение массы тела.
Со стороны нервной системы: очень часто — головная боль, головокружение.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — одышка, в т.ч. одышка при физической нагрузке; часто — кашель, носовое кровотечение.
Со стороны ЖКТ: очень часто — абдоминальная боль, диарея; часто — запор, тошнота.
Со стороны печени и желчевыводящих путей: очень часто — повышение активности АЛТ, повышение активности ACT; нечасто — повышение активности АЛТ 3-й степени (в 5–20 раз выше нормы).
Со стороны скелетно-мышечной системы и соединительной ткани: очень часто — мышечные спазмы; часто — артралгия.
Со стороны сосудов: часто — выраженное повышение АД.
Общие расстройства и нарушения в месте ведения: очень часто — усталость; часто — астения, отек, в т.ч. периферические отеки.
Если любые из указанных в описании побочных эффектов усугубляются, или вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Поскольку клинические исследования проводятся в разных условиях, частота встречаемости побочных действий в клинических исследованиях ЛС не может быть непосредственно сравнена с количественной оценкой неблагоприятных эффектов, наблюдавшихся в других клинических испытаниях, и может не отражать частоту встречаемости этих эффектов в клинической практике.
Опыт клинических испытаний при миелофиброзе
Безопасность руксолитиниба оценивалась у 617 пациентов в 6 клинических исследованиях с медианой продолжительности наблюдения 10,9 мес, включая 301 пациента с миелофиброзом в 2 исследованиях фазы 3.
В этих 2 исследованиях фазы 3 медиана продолжительности экспозиции руксолитиниба была 9,5 мес (диапазон от 0,5 до 17 мес), 89% пациентов получали руксолитиниб в течение более 6 мес и 25% — в течение более 12 мес. 111 пациентов начали лечение с 15 мг руксолитиниба 2 раза в день и 190 пациентов — с 20 мг 2 раза в день. Из пациентов, начавших прием ЛС с 15 мг 2 раза в день (количество тромбоцитов до лечения от 100 до 200·109/л) и 20 мг 2 раза в день (количество тромбоцитов до лечения более 200·109/л), 65 и 25% пациентов соответственно потребовалось снижение дозы ниже стартовой в течение первых 8 нед терапии.
В двойном слепом рандомизированном плацебо-контролируемом исследовании у 155 пациентов, получавших руксолитиниб, наиболее частыми побочными реакциями были тромбоцитопения и анемия. Развитие тромбоцитопении, анемии и нейтропении носило дозозависимый характер. Тремя наиболее частыми негематологическими побочными реакциями были подкожные гематомы, головокружение и головная боль.
Прекращение лечения в результате развития нежелательных явлений, независимо от причины, было зафиксировано у 11% пациентов, получавших руксолитиниб, и 11% пациентов, получавших плацебо.
В двойном слепом плацебо-контролируемом исследовании в период рандомизации наиболее распространенными побочными реакциями всех степеней тяжести в соответствии с критериями CTCAE1 или 3–4-й степени (приведены в скобках, через /), возникавшими у пациентов с миелофиброзом, которые получали руксолитиниб (N=155), в сравнении с плацебо (N=151) были следующие (в процентах).
Синяки2 23 (<1/0) и 15 (0/0).
Головокружение3 18 (<1/0) и 7 (0/0).
Головная боль 15 (0/0) и 5 (0/0).
Инфекции мочевыводящих путей4 9 (0/0) и 5 (<1/<1).
Увеличение массы тела5 7 (<1/0) и 1 (<1/0).
Метеоризм 5 (0/0) и <1 (0/0).
Herpes Zoster6 2 (0/0) и <1 (0/0).
1 Критерии стандартной терминологии нежелательных явлений Национального института рака (CTCAE), версия 3.0.
2 Включает ушиб, экхимоз, гематому, в т.ч. в месте инъекции, периорбитальную гематому, повышенную склонность к синякам, петехии, пурпуру.
3 Включает головокружение, постуральное головокружение, вертиго, нарушение равновесия, болезнь Меньера, лабиринтит.
4 Включает инфекции мочевыводящих путей, цистит, уросепсис, бактериальные инфекции мочевыводящих путей, инфекции почек, пиурию, выявление бактерий в моче, наличие нитритов в моче.
5 Включает увеличение массы тела, в т.ч. аномальное.
6 Включает Herpes Zoster и постгерпетическую невралгию.
Описание отдельных нежелательных лекарственных реакций
Анемия. В 2 клинических исследованиях фазы 3 медиана времени до начала развития первого НЯ 2-й степени или выше (в соответствии с CTCAE) — анемии — составила примерно 6 нед. У одного пациента (<1%) лечение было прекращено из-за развития анемии. У пациентов, получавших руксолитиниб, уровень гемоглобина снижался до значений, примерно на 1,5–2 г/дл ниже исходного уровня, после 8–12 нед терапии, а затем постепенно повышался и сохранялся на уровне, который был приблизительно на 1 г/дл ниже исходного. Эта картина наблюдалась у больных независимо от того, проводили ли им трансфузию во время терапии или нет.
В рандомизированном плацебо-контролируемом исследовании у 60% пациентов, принимавших руксолитиниб, и 38% пациентов из группы плацебо было проведено переливание эритроцитарной массы в период рандомизации. Среди пациентов, которым проводили трансфузию, медиана количества переливаний в месяц составила 1,2 у больных, получавших руксолитиниб, и 1,7 у больных, получавших плацебо.
Тромбоцитопения. В двух клинических исследованиях фазы 3 у пациентов, у которых развилась тромбоцитопения 3-й или 4-й степени, медиана времени до ее развития была примерно 8 нед. Тромбоцитопения была обычно обратимой при снижении дозы или временном прерывании приема руксолитиниба. Медиана времени до восстановления количества тромбоцитов выше 50·109/л составила 14 дней. Трансфузия тромбоцитов была проведена у 5% пациентов, получавших руксолитиниб, и у 4% пациентов, находившихся на контрольном режиме. Прекращение лечения из-за развития тромбоцитопении было отмечено в <1% случаев у пациентов, получавших руксолитиниб, и у <1% пациентов, находившихся на контрольном режиме. У пациентов с количеством тромбоцитов от 100·109/л до 200·109/л до начала лечения руксолитинибом была более высокая частота тромбоцитопении 3-й или 4-й степени по сравнению с пациентами, у которых количество тромбоцитов было больше чем 200·109/л (17 против 7%).
Нейтропения. В 2 клинических исследованиях фазы 3 у 1% больных был временно прекращен прием или снижена доза руксолитиниба из-за развития нейтропении.
Ниже представлены отклонения гематологических лабораторных показателей, наблюдавшиеся в плацебо-контролируемом исследовании1 и отмеченные при гематологических неблагоприятных реакциях всех степеней тяжести по классификации CTCAE2 3-й и 4-й степени (приведены в скобках, через /) у пациентов с миелофиброзом, которые получали руксолитиниб (N=155), в сравнении с плацебо (N=151) (в процентах).
Тромбоцитопения 70 (9/4) и 31 (1/0).
Анемия 96 (34/11) и 87 (16/3).
Нейтропения 19 (5/2) и 4 (<1/1).
1 Представленные величины являются наибольшими отклонениями, независимо от исходного уровня.
2 Критерии стандартной терминологии нежелательных явлений Национального института рака (CTCAE), версия 3.0.
Дополнительные данные плацебо-контролируемого исследования
У 25% пациентов, получавших руксолитиниб, и 7% пациентов, получавших плацебо, отмечались отклонения АЛТ степени 1 (вновь развившиеся или ухудшение показателей). Повышение АЛТ 2-й степени и больше при приеме руксолитиниба составляло 2%, 3-й и 4-й степени — 1%.
17% пациентов, получавших руксолитиниб, и 6% больных, получавших плацебо, отмечались отклонения АСТ (вновь развившиеся или ухудшение показателей). Увеличение АСТ 2-й степени при приеме руксолитиниба было <1%, 3-й или 4-й степени — не отмечалось.
17% пациентов, получавших руксолитиниб, и <1% пациентов, получавших плацебо, отмечались отклонения уровня холестерина (вновь развившиеся или ухудшение показателей). Повышение холестерина 2-й степени при приеме руксолитиниба было <1%, 3-й или 4-й степени — не отмечалось.
Опыт клинических исследований при истинной полицитемии
В рандомизированном открытом актив-контролируемом исследовании 110 пациентов с истинной полицитемией, при резистентности или непереносимости гидроксимочевины, получали руксолитиниб, и 111 пациентов получали наилучшую доступную терапию. Наиболее частой побочной лекарственной реакцией была анемия.
Прекращение приема ЛС из-за развития неблагоприятных событий, независимо от причины, наблюдалось у 4% пациентов, получавших руксолитиниб.
В открытом актив-контролируемом исследовании сроком до 32 нед в период рандомизации у пациентов с истинной полицитемией были отмечены следующие связанные с лечением неблагоприятные реакции, наблюдавшиеся у ≥ 6% пациентов, принимавших руксолитиниб (N=110), всех степеней тяжести в соответствии с критериями CTCAE1 или 3-й и 4-й степени (приведены в скобках, через /), в сравнении с наилучшей имеющийся терапией (N=111) (в процентах).
Головная боль 16 (<1) и 19 (<1).
Боль в животе2 15 (<1) и 15 (<1).
Диарея 15 (0) и 7 (<1).
Головокружение3 15 (0) и 13 (0).
Усталость 15 (0) и 15 (3).
Зуд 14 (<1) и 23 (4).
Диспноэ4 13 (3) и 4 (0).
Мышечные спазмы 12 (<1) и 5 (0).
Назофарингит 9 (0) и 8 (0).
Запор 8 (0) и 3 (0).
Кашель 8 (0) и 5 (0).
Эдема5 8 (0) и 7 (0).
Артралгия 7 (0) и 6 (<1).
Астения 7 (0) и 11 (2).
Носовое кровотечение 6 (0) и 3 (0).
Herpes Zoster6 6 (<1) и 0 (0).
Тошнота 6 (0) и 4 (0).
1 Критерии стандартной терминологии нежелательных явлений Национального института рака (CTCAE), версия 3.0.
3 Включает боль в животе, в т.ч. в нижней и верхней части.
3 Включает головокружение и вертиго.
4 Включает одышку и одышку при физической нагрузке.
5 Включает отеки, в т.ч. периферические.
6 Включает Herpes Zoster и постгерпетическую невралгию.
Другие клинически важные, возникавшие в связи с лечением, НЯ, наблюдавшиеся менее чем у 6% пациентов, получавших руксолитиниб: увеличение массы тела, гипертензия, инфекции мочевыводящих путей.
Далее представлены отклонения отдельных важных лабораторных показателей, зафиксированные в открытом актив-контролируемом исследовании до 32 нед в период рандомизации1 у пациентов с истинной полицитемией, получавших руксолитиниб (N=110), всех степеней тяжести в соответствии с критериями CTCAE2 или 3-й и 4-й степени (приведены в скобках, через /), в сравнении с наилучшей имеющийся терапией (N=111) (в процентах).
Гематология. Анемия 72 (<1/<1) и 58 (0/0).
Тромбоцитопения 27 (5/<1) и 24 (3/<1).
Нейтропения 3 (0/<1) и 10 (<1/0).
Биохимия. Гиперхолестеринемия 35 (0/0) и 8 (0/0).
Повышение АЛТ 25 (<1/0) и 16 (0/0).
Повышение АСТ 23 (0/0) и 23 (<1/0).
Гипертриглицеридемия 15 (0/0) и 13 (0/0).
1 Представленные величины являются наибольшими отклонениями, независимо от исходного уровня.
2 Критерии стандартной терминологии нежелательных явлений Национального института рака (CTCAE), версия 3.0.
Взаимодействие
Средства, которые могут изменить концентрацию руксолитиниба в плазме крови
Сильные ингибиторы изофермента CYP3A4. У здоровых добровольцев прием кетоконазола, сильного ингибитора изофермента CYP3A4, в дозе 200 мг 2 раза в день в течение 4 дней, приводил к повышению AUC руксолитиниба на 91% и удлинению T1/2 с 3,7 до 6 ч.
В случае применения с сильными ингибиторами изофермента CYP3A4 общая суточная доза руксолитиниба должна быть снижена приблизительно на 50%.
За пациентами необходимо осуществлять тщательное наблюдение на предмет снижения количества форменных элементов крови, при необходимости рекомендуется дальнейшая коррекция дозы на основании данных эффективности и безопасности.
Сильные ингибиторы изофермента CYP3A4. В испытании у 16 здоровых добровольцев, которые принимали однократную дозу руксолитиниба 10 мг в 1-й день, а также ту же дозу руксолитиниба в 5-й день совместно с кетоконазолом (сильным ингибитором изофермента CYP3A4) 200 мг 2 раза в день со 2-го по 5-й день, кетоконазол повышал Cmax руксолитиниба на 33%, AUC — на 91% и удлинял T1/2 руксолитиниба с 3,7 до 6 ч.
Слабые и умеренные ингибиторы изофермента CYP3A4. Прием эритромицина, умеренного ингибитора изофермента CYP3A4, в дозе 500 мг 2 раза в день у здоровых добровольцев в течение 4 дней приводил к повышению на 27% AUC руксолитиниба.
Слабые и умеренные ингибиторы изофермента CYP3A4. В испытании у 15 здоровых добровольцев, которые принимали однократную дозу руксолитиниба 10 мг в 1-й день, а также ту же дозу руксолитиниба в 5-й день совместно с эритромицином (умеренным ингибитором изофермента CYP3A4) 500 мг 2 раза в день со 2-го по 5-й день, эритромицин приводил к повышению Cmax руксолитиниба на 8% и AUC — на 27%.
Коррекция дозы не требуется при одновременном применении руксолитиниба со слабыми или умеренными ингибиторами изофермента CYP3A4 (в т.ч. эритромицин). В начале терапии руксолитинибом одновременно с умеренными ингибиторами изофермента CYP3A4 требуется тщательное наблюдение за пациентами и оценка количества форменных элементов крови.
Двойные умеренные ингибиторы изоферментов CYP2C9 и CYP3A4. На основании результатов моделирования лекарственного взаимодействия ожидается увеличение AUC руксолитиниба в 2,9 и 4,3 раза при одновременном применении с флуконазолом в дозах 200 и 400 мг соответственно. Дозу руксолитиниба следует уменьшить на 50% при одновременном применении с двойными умеренными ингибиторами изоферментов CYP2C9 и CYP3A4. Следует избегать одновременного применения руксолитиниба с флуконазолом в дозе, превышающей 200 мг в день.
Флуконазол. Результаты моделирования с использованием физиологической модели фармакокинетики свидетельствуют о том, что флуконазол (двойной ингибитор изоферментов CYP2C9 и CYP3A4) повышает AUC руксолитиниба в равновесном состоянии приблизительно от 100 до 300% при одновременном применении 10 мг руксолитиниба 2 раза в день с флуконазолом в дозах от 100 до 400 мг 1 раз в день соответственно.
Индукторы изофермента CYP3A4. В начале лечения одновременно с индукторами изофермента CYP3A4 коррекция дозы не рекомендована. Если эффективность терапии руксолитинибом снижается при одновременной терапии индукторами изофермента CYP3A4, необходимо рассмотреть постепенное увеличение дозы руксолитиниба.
У здоровых добровольцев, получавших рифампицин (сильный индуктор изофермента CYP3A4) в дозе 600 мг 1 раз в день в течение 10 дней AUC руксолитиниба после приема однократной дозы уменьшалась на 71%, и T1/2 снижался с 3,3 до 1,7 ч. Относительное количество активных метаболитов повышалось по отношению к исходному веществу.
Индукторы изофермента CYP3A4. В исследовании у 12 здоровых добровольцев, получавших однократную дозу руксолитиниба 50 мг в 1-й день, а также однократную дозу руксолитиниба 50 мг на 13-й день совместно с рифампицином (сильным индуктором изофермента CYP3A4) в дозе 600 мг с 3-го по 13-й день рифампицин снижал Cmax и AUC руксолитиниба на 32 и 61% соответственно. Кроме того, относительная экспозиция активных метаболитов руксолитиниба повышалась на 100%.
Коррекция дозы не рекомендована. Однако необходимы периодический мониторинг пациентов и коррекция дозы руксолитиниба на основании данных безопасности и эффективности.
Р-gp и другие белки-переносчики. Не рекомендуется коррекция дозы при применении руксолитиниба одновременно с ЛС, взаимодействующими с Р-gp и другими белками-переносчиками.
Другие изученные лекарственные взаимодействия
Субстраты CYP3A4. Исследование у здоровых добровольцев продемонстрировало отсутствие клинически значимого фармакокинетического взаимодействия руксолитиниба с мидазоламом (субстрат изофермента CYP3A4).
Пероральные контрацептивы. Исследование у здоровых добровольцев продемонстрировало отсутствие влияния руксолитиниба на фармакокинетику пероральных контрацептивов, содержащих этинилэстрадиол и левоноргестрел, в связи с чем не ожидается снижение эффективности пероральных контрацептивов с данной комбинацией действующих веществ при одновременном применении с руксолитинибом.
In vitro исследования. In vitro руксолитиниб и его метаболит M18 не ингибируют CYP1A2, CYP2C8, CYP2B6, CYP2C9, CYP2C19, CYP2D6 или CYP3A4. Руксолитиниб не является индуктором CYP1A2, CYP3A4 или CYP2B6 в клинически значимых концентрациях.
In vitro руксолитиниб и его метаболит M18 не ингибируют транспортные системы Р-gp, BCRP, OATP1B1, OATP1B3, OCT1, OCT2, OAT1 и OAT3 в клинически значимых концентрациях. Руксолитиниб не является субстратом для Р-gp-переносчика.
Пути введения
Внутрь.
Меры предосторожности
Снижение количества форменных элементов крови
Лечение руксолитинибом может приводить к развитию гематологических нежелательных реакций, включающих тромбоцитопению, анемию и нейтропению. До начала лечения руксолитинибом необходимо провести общий анализ крови.
Тромбоцитопения. У пациентов со сниженным количеством тромбоцитов (<200·109/л) в начале терапии приблизительно в 2 раза возрастает вероятность развития тромбоцитопении во время лечения руксолитинибом. В клинических исследованиях у пациентов с миелофиброзом тромбоцитопения 3-й или 4-й степени тяжести развивалась приблизительно к 8-й нед терапии. Тромбоцитопения, в целом, обратима и обычно корректируется снижением дозы или временным прекращением приема руксолитиниба. Количество тромбоцитов восстанавливалось до значений более 50·109/л в течение 14 дней. Тем не менее, в некоторых случаях может потребоваться трансфузия концентратов тромбоцитов.
У пациентов с истинной полицитемией тромбоцитопения отмечалась реже (24,5%), чем у пациентов с миелофиброзом (69,8%). Тромбоцитопения 3-й и 4-й степени тяжести отмечалась у 5,54% пациентов с истинной полицитемией и у 11,6% пациентов с миелофиброзом.
Анемия. При развитии анемии может потребоваться переливание эритроцитной массы. Кроме того, необходимо оценить необходимость коррекции дозы или прерывания лечения руксолитинибом. Примерно 50% пациентов с миелофиброзом, участвовавших в клинических исследованиях и получавших руксолитиниб, и 37% пациентов в группе контроля в ходе исследования потребовалось переливание эритроцитной массы. У пациентов, получавших руксолитиниб, концентрация гемоглобина достигала максимально низкого уровня (на 15–20 г/л ниже исходного показателя) на 8–12 нед терапии. В дальнейшем концентрация гемоглобина постепенно повышалась и сохранялась на уровне на 10 г/л ниже исходной (до начала лечения). Данная тенденция наблюдалась независимо от того, получал ли пациент гемотрансфузию во время терапии.
У пациентов с истинной полицитемией анемия отмечалась реже (46,8%), чем у пациентов с миелофиброзом (82,4%). Анемия 3-й и 4-й степени тяжести отмечалась у 1,8% пациентов с истинной полицитемией и у 42,5% пациентов с миелофиброзом.
Нейтропения. У пациентов с миелофиброзом нейтропения 3-й и 4-й степени развивалась приблизительно к 12 нед терапии. В целом нейтропения (абсолютное число нейтрофилов <0,5·109/л), в случае ее развития, была обратима и корректировалась временной отменой приема руксолитиниба. У пациентов с истинной полицитемией нейтропения была отмечена у 2 пациентов, при этом у одного из пациентов отмечено развитие нейтропении 4-й степени тяжести.
Кровотечения. Кровотечения (включая внутричерепные кровоизлияния, желудочно-кишечные кровотечения, подкожные кровоизлияния, петехии, пурпуру и другие кровотечения) были зарегистрированы у 32,6% пациентов, получавших руксолитиниб. 65,3% всех кровотечений составляли случаи развития подкожных гематом, которые отмечались у 21,3% пациентов. Частота развития кровотечений 3-й и 4-й степени тяжести составляла 4,7%. Случаи развития внутричерепных кровоизлияний были отмечены у 1% пациентов, желудочно-кишечных кровотечений — у 5% пациентов, кровотечений вследствие других причин (в т.ч. носовое кровотечение, послеоперационные кровотечения и гематурия) — у 13,3% пациентов, получавших руксолитиниб.
Инфекции. Перед применением руксолитиниба следует оценить наличие/риск развития тяжелых бактериальных, микобактериальных, грибковых и вирусных инфекций. У пациентов, получавших руксолитиниб, сообщалось о случаях развития туберкулеза. Следует помнить о возможности развития активной или латентной формы туберкулеза. Не следует начинать терапию руксолитинибом до разрешения тяжелого активного инфекционного процесса. Следует тщательно наблюдать пациентов, получающих руксолитиниб, на предмет развития симптомов инфекции и в случае необходимости незамедлительно начинать соответствующее лечение.
У пациентов с хроническим вирусным гепатитом В, получающих руксолитиниб, отмечалось увеличение титра ДНК вируса гепатита В как с, так и без сопровождающего увеличения активности ACT и АЛТ. Неизвестно влияние руксолитиниба на репликацию ДНК вируса гепатита В. Лечение и контроль состояния пациентов с хроническим вирусным гепатитом В следует проводить в соответствии с общепринятыми стандартами клинической практики.
Опоясывающий герпес. Перед применением руксолитиниба врачу следует обучить пациента своевременному выявлению ранних симптомов опоясывающего герпеса, сообщив о необходимости раннего начала лечения.
Прогрессирующая мультифокальная лейкоэнцефалопатия. При применении руксолитиниба было получено сообщение о случае развития ПМЛ. При подозрении на развитие ПМЛ следует прекратить применение руксолитиниба.
Злокачественные новообразования кожи, за исключением меланомы. При применении руксолитиниба сообщалось о случаях развития злокачественных новообразований кожи, за исключением меланомы, в т.ч. базальноклеточной и плоскоклеточной карциномы, а также карциномы из клеток Меркеля. В большинстве случаев у таких пациентов в анамнезе проводилось продолжительное лечение препаратами гидроксимочевины или ранее были выявлены злокачественные новообразования кожи, за исключением меланомы, или предраковые поражения кожи. Причинно-следственная связь с применением руксолитиниба не была установлена. Рекомендуется проводить периодическое обследование кожных покровов у пациентов с повышенным риском развития злокачественных новообразований кожи.
Синдром отмены. После прекращения терапии руксолитинибом симптомы миелофиброза (такие как усталость, боль в костях, лихорадка, зуд, ночная потливость, симптоматическая спленомегалия и снижение массы тела) могут возвращаться. В клинических исследованиях общая шкала симптомов миелофиброза постепенно возвращалась к исходным показателям в течение 7 дней после прекращения применения.
Симптомы обострения миелофиброза после приостановки или прекращения лечения руксолитинибом. После прекращения терапии руксолитинибом симптомы миелофиброза обычно возвращаются к исходным в течение примерно 1 нед. У некоторых пациентов были случаи одной или более из следующих неблагоприятных реакций после прекращения приема руксолитиниба: лихорадка, респираторный дистресс-синдром, гипотензия, ДВС или полиорганная недостаточность. Если один или более из этих симптомов отмечаются после прекращения лечения или во время снижения дозы руксолитиниба, необходимо оценить и лечить интеркуррентные заболевания и рассмотреть возможность возобновления приема или увеличение дозы руксолитиниба. Следует проинструктировать пациентов о том, чтобы не прерывать и не прекращать терапию руксолитинибом без консультации с врачом. При прекращении или прерывании терапии руксолитинибом по иным, нежели тромбоцитопения или нейтропения, причинам предпочтительнее снизить дозу постепенно, нежели резко прекратить лечение.
Особые группы пациентов
Нарушение функции почек. У пациентов с миелофиброзом и нарушением функции почек тяжелой степени (Cl креатинина менее 30 мл/мин) рекомендуемая начальная доза, основанная на числе тромбоцитов, должна быть снижена приблизительно на 50%. Рекомендуемая начальная доза при лечении пациентов с истинной полицитемией и нарушением функции почек тяжелой степени составляет 5 мг 2 раза в день внутрь.
Пациенты с нарушением функции почек тяжелой степени, получающие руксолитиниб, должны тщательно наблюдаться, и при необходимости доза ЛС должна быть снижена во избежание развития нежелательных лекарственных реакций.
Имеются ограниченные данные по применению руксолитиниба у пациентов с терминальной стадией почечной недостаточности на гемодиализе. У данной категории пациентов с миелофиброзом лечение следует начинать с приема однократной дозы 15 или 20 мг (на основании количества тромбоцитов), с последующими однократными дозами после каждой процедуры гемодиализа при тщательной оценке соотношения польза/риск.
У пациентов с истинной полицитемией и терминальной стадией почечной недостаточности на гемодиализе лечение следует начинать с приема однократной дозы 10 мг после процедуры гемодиализа только в день ее проведения при тщательном контроле состояния и оценке соотношения польза/риск.
Почечная недостаточность. Безопасность и фармакокинетика однократной дозы руксолитиниба (25 мг) были оценены в исследовании у здоровых добровольцев (Cl креатинина 72–164 мл/мин (N=8) и людей с легкой (Cl креатинина 53–83 мл/мин (N=8), умеренной (Cl креатинина 38–57 мл/мин (N=8), тяжелой почечной недостаточностью (Cl креатинина 15–51 мл/мин (N=8), а также у 8 дополнительных субъектов с терминальной стадией почечной недостаточности, требующей проведения гемодиализа.
Фармакокинетика руксолитиниба была схожей при различной степени почечной недостаточности и нормальной функции почек. Однако значения AUC метаболитов руксолитиниба в плазме увеличивались при увеличении степени тяжести почечной недостаточности. Это было наиболее заметно у людей с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе. Изменение фармакодинамического показателя, ингибирование рSTAT3 согласуется с соответствующим увеличением экспозиции метаболита. Руксолитиниб не удаляется с помощью диализа; однако удаление некоторых активных метаболитов путем диализа не может быть исключено.
При приеме руксолитиниба пациентами с умеренной (Cl креатинина 30–59 мл/мин) или тяжелой почечной недостаточностью (Cl креатинина 15–29 мл/мин) с количеством тромбоцитов от 100·109/л и 150·109/л и пациентами с терминальной стадией заболевания почек, нахожящихся на диализе, рекомендуется снижение дозы.
Нарушение функции печени. У пациентов с нарушением функции печени рекомендуемая начальная доза, основанная на числе тромбоцитов, должна быть снижена приблизительно на 50%. Пациенты с диагностированным нарушением функции печени тяжелой степени, получающие руксолитиниб, должны тщательно наблюдаться, и при необходимости доза ЛС должна быть снижена во избежание развития нежелательных лекарственных реакций.
Печеночная недостаточность. Безопасность и фармакокинетика однократной дозы руксолитиниба (25 мг) были оценены в исследовании у здоровых добровольцев (N=8) и у пациентов с легкой (класс А по классификации Чайлд-Пью (N=8), умеренной (класс В по классификации Чайлд-Пью (N=8) или тяжелой печеночной недостаточностью (класс C по классификации Чайлд-Пью (N=8). Среднее значение AUC руксолитиниба было увеличено на 87, 28 и 65% соответственно у пациентов с легкой, средней и тяжелой печеночной недостаточностью по сравнению с пациентами с нормальной функцией печени. Терминальный T1/2 был пролонгирован у пациентов с печеночной недостаточностью по сравнению со здоровыми добровольцами (4,1–5 ч против 2,8 ч). Изменение фармакодинамического показателя, ингибирование STAT3 согласуется с соответствующим увеличением в экспозиции руксолитиниба, за исключением группы с тяжелой (класс C по классификации Чайлд-Пью) печеночной недостаточностью, где фармакодинамическая активность у некоторых людей была более продолжительной, чем ожидалось на основе плазменных концентраций руксолитиниба.
При приеме руксолитиниба пациентами с любой степенью печеночной недостаточности и с количеством тромбоцитов между 100·109/л и 150·109/л рекомендуется снижение дозы.
Пациенты в возрасте ≤18 лет. Безопасность и эффективность руксолитиниба у пациентов в возрасте ≤18 лет не установлена.
Пациенты в возрасте ≥65 лет. Коррекция дозы ЛС не требуется.
Применение в гериатрии. Из общего числа пациентов с миелофиброзом в клинических исследованиях руксолитиниба 51,9% были в возрасте 65 лет и старше. Не обнаружено различий в безопасности и эффективности руксолитиниба между пациентами этого возраста и более молодыми пациентами.
Влияние на способность управлять транспортными средствами и/или механизмами. Исследования влияния руксолитиниба на способность к управлению транспортными средствами и/или механизмами не проводились. Учитывая возможность развития некоторых побочных эффектов на фоне приема руксолитиниба (головокружение), пациентам следует соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания.
Передозировка
Симптомы: применение руксолитиниба однократно в дозе до 200 мг переносилось удовлетворительно. Превышение рекомендуемых доз ассоциировалось с усилением миелосупрессии, что проявлялось лейкопенией, анемией и тромбоцитопенией.
Лечение: при развитии нежелательных явлений, связанных с передозировкой руксолитиниба, необходимо применить соответствующее поддерживающее лечение.
Гемодиализ неэффективен.
Антидот к руксолитинибу неизвестен.
Особые указания
Следует соблюдать осторожность у пациентов с дефицитом лактазы, непереносимостью лактозы, глюкозо-галактозной мальабсорбцией.